实验室制取二氧化碳是初中化学教学中的基础实验之一,其核心原理基于碳酸钙与稀盐酸的中和反应。以下从反应原理、实验装置、操作步骤、收集方法、检验与验满、注意事项及研究进展等方面进行综合阐述,并结合最新研究成果探讨相关技术的发展。
一、反应原理
实验室制取二氧化碳的化学反应方程式为:
CaCO₃ + 2HCl → CaCl₂ + H₂O + CO₂↑
该反应利用碳酸钙(大理石或石灰石的主要成分)与稀盐酸的复分解反应生成二氧化碳气体。选择稀盐酸而非其他酸的原因包括:
1. 稀硫酸会生成微溶的硫酸钙覆盖在碳酸钙表面,阻碍反应持续进行;

2. 浓盐酸易挥发,导致生成的CO₂中混入HCl气体;
3. 碳酸钠或碳酸氢钠反应速率过快,难以控制。
二、实验装置与操作步骤
1. 装置组成
2. 操作步骤
1. 检查气密性:通过注水法或夹闭导管观察液柱是否稳定。
2. 装填药品:向锥形瓶中加入大理石碎块,通过长颈漏斗缓慢注入稀盐酸。
3. 收集气体:导管伸入集气瓶底部,利用向上排空气法收集。
4. 验满:将燃着的木条置于瓶口,若熄灭则证明集满。
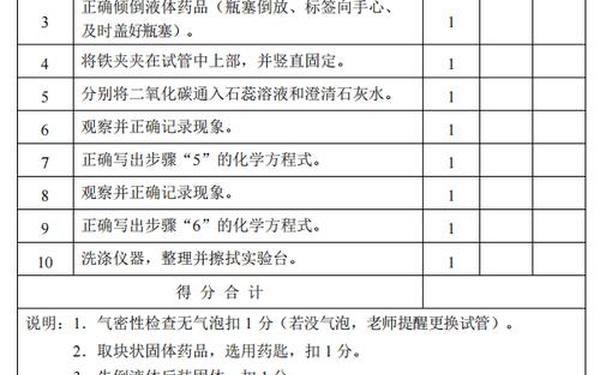
三、气体检验与收集方法
四、注意事项
1. 原料选择:
2. 装置优化:
3. 安全与环保:
五、研究进展与扩展应用
近年来,二氧化碳的催化转化研究取得突破,例如:
1. 电化学还原:通过设计非对称铜纳米团簇催化剂(Cu Clu/GAs),实现CO₂高效转化为乙醇,选择性显著提升。
2. 热催化还原:利用锰掺杂镍纳米颗粒封装于分子筛中,在450°C下CO₂转化率达84.62%,甲烷选择性达98.02%。
3. 超临界CO₂技术:应用于微发泡塑料制备,降低能耗并提升材料性能,推动环保材料产业化。
实验室制取二氧化碳的实验设计需综合考虑反应速率、气体纯度及操作安全性。当前研究趋势正从基础制备转向高附加值利用,例如催化转化为燃料或环保材料,这为碳中和目标提供了技术支撑。教学中可通过对比不同实验条件(如酸浓度、反应物形态)深化学生对化学反应动力学的理解。

