一、法规依据与提交要求
1. 法规依据
《医疗器械监督管理条例》第三十五条:明确要求注册人、备案人、受托生产企业每年提交自查报告,未提交将面临警告、罚款(1-10万元)或吊销许可证等处罚。
《医疗器械生产监督管理办法》第四十五条:规定报告需在次年3月31日前提交,进口企业通过境内代理人提交。
国家药监局《医疗器械质量管理体系年度自查报告编写指南》:提供具体内容框架。
2. 提交对象
境内企业:医疗器械注册人、备案人、受托生产企业;
进口企业:由其境内代理人提交至代理人所在地省级药监部门。
3. 截止时间
2024年度报告需在2025年3月31日前完成提交,逾期将触发行政处罚。
二、自查报告核心内容
1. 综述部分
生产活动概况:企业基本信息、生产地址、许可证号、产品注册/备案情况及产量(含委托生产)。
委托生产管理:明确委托方与受托方信息、质量协议履行情况。
2. 年度重要变更
设计变更:涉及产品安全、性能的变更需完成验证并上报注册变更。
生产环境与设备:场地布局、关键设备变化需详细说明。
供应商变更:主要原材料、关键元器件供应商变更需评价。
3. 质量管理体系运行
人员与培训:组织架构调整、关键岗位人员资质及培训记录。
生产控制:设备维护、校准记录、不合格品处理及召回情况。
追溯与监测:UDI实施情况、不良事件上报及风险评价报告。
内审与管理评审:年度内审次数、整改项完成率。
4. 其他事项
监管检查:年度接受药监部门检查的问题及整改结果。
行政处罚:企业受罚情况(含境外监管处罚)。
三、提交路径与注意事项
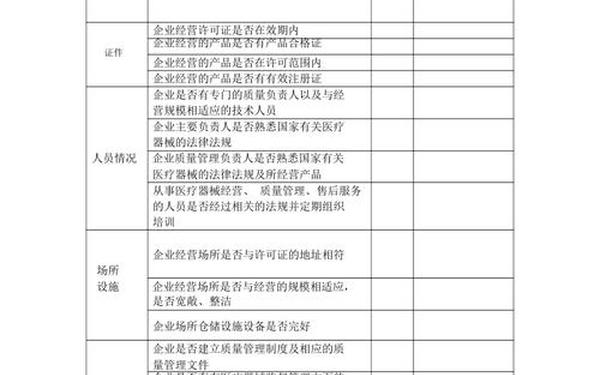
1. 境内企业
线上系统:登录国家药监局“医疗器械生产企业监管系统”填报,需注册企业账号。
线下填报:部分省份(如广东)需通过“智慧药监”平台或向当地分局提交纸质版。
2. 进口企业

使用专用模板(如网页37提供的模板),由代理人汇总后提交。
3. 常见风险
数据不完整:遗漏委托生产信息、变更未说明或供应商评价缺失;
逻辑矛盾:如内审发现问题但整改率未达100%;
超期提交:3月31日后系统关闭,逾期企业将被重点监管。
四、实操建议
1. 提前准备:整理全年生产记录、变更文件、内审报告等,确保数据可追溯。
2. 模板参考:
境内企业:参考国家药监局模板(附件1);
进口企业:使用代理人专用模板(如网页37示例)。
3. 合规自查:重点关注委托生产协议有效性、UDI编码覆盖率、不良事件闭环管理。
未按时提交的后果:企业可能被责令停产、吊销许可证,且法定代表人或负责人面临1-3万元罚款。建议企业优先通过线上系统提交,并保留回执作为合规凭证。



