1. 教学目标
知识与技能:
掌握化学反应速率的定义及定量表示方法,能进行简单计算(如通过浓度变化计算平均速率)。
理解浓度、温度、催化剂等因素对速率的影响,并能用活化能理论解释其原理。
过程与方法:
通过实验探究(如浓度对比实验、催化剂效果实验)培养观察能力和数据分析能力。
情感态度与价值观:
认识催化剂在工业中的重要性,体会化学理论的实际应用价值。
2. 教学重点与难点
重点:浓度、温度、催化剂对速率的影响规律;活化能的概念。
难点:瞬时速率的理解(需结合图像和微分思想)及活化能的微观解释。
3. 教学过程设计
(1)导入环节
情境创设:演示对比实验(如镁条与不同浓度盐酸反应的快慢差异),引导学生观察现象并思考“反应快慢如何定量描述”。
(2)概念讲解
化学反应速率的定义:
通过类比物理速率(单位时间位移变化)引出化学反应速率的定义:单位时间内反应物浓度的减少或生成物浓度的增加。
公式:平均速率 ( v = frac{Delta c}{Delta t} ),强调浓度的变化方向(反应物为负,生成物为正)。
(3)实验探究
实验1(浓度影响):
对比不同浓度盐酸与大理石的反应速率,记录气泡产生速度,总结“浓度越大,速率越快”。
实验2(催化剂影响):
以 ( 2H_2O_2 rightarrow 2H_2O + O_2 ) 为例,加入 ( MnO_2 ) 后观察氧气生成速率的显著提升。
(4)理论深化
活化能理论:
解释有效碰撞与活化分子的关系,结合图像说明温度升高或催化剂如何通过降低活化能提高有效碰撞概率。
阿伦尼乌斯方程(拓展):
公式 ( k = A e^{-E_a/(RT)} ),说明温度对速率常数的影响。
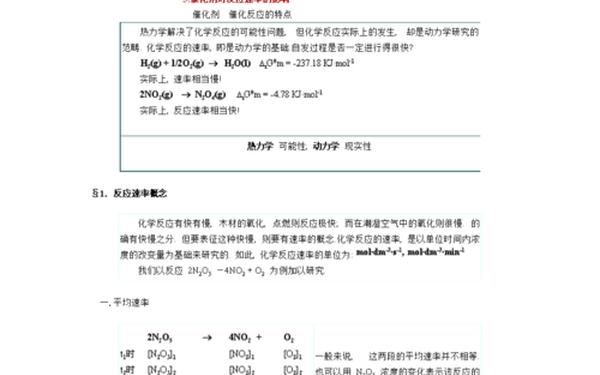
二、化学反应瞬时速率公式
1. 公式表达式
对于反应 ( aA + bB rightarrow cC + dD ),瞬时速率公式为:

[
v = -frac{1}{a} frac{d[A]}{dt} = -frac{1}{b} frac{d[B]}{dt} = frac{1}{c} frac{d[C]}{dt} = frac{1}{d} frac{d[D]}{dt}
]
其中:
( [A], [B], [C], [D] ) 表示各物质的瞬时浓度;
( d[A]/dt ) 等为浓度对时间的导数,数学上对应曲线的瞬时斜率。
2. 计算方法
差分法:
通过实验数据中相邻时间点的浓度差近似计算瞬时速率(如 ( v approx frac{Delta [A]}{Delta t} )),适用于数据间隔较小的情况。
曲线拟合法:
将浓度-时间数据拟合为函数(如指数衰减函数),对其求导得到瞬时速率,精度更高。
3. 应用实例
以反应 ( N_2 + 3H_2 rightarrow 2NH_3 ) 为例:
若测得某时刻 ( [N_2] ) 的瞬时变化率为 ( -0.02 ,
ext{mol/(L·s)} ),则此时反应速率为:
[
v = -frac{d[N_2]}{dt} = 0.02 ,
ext{mol/(L·s)}
]
( H_2 ) 和 ( NH_3 ) 的速率分别为 ( 0.06 ,
ext{mol/(L·s)} ) 和 ( 0.04 ,
ext{mol/(L·s)} ),符合化学计量比。
三、参考资料与教学建议
实验设计:参考网页11的浓度对比实验和网页40的催化剂实验,结合生活实例(如酶催化)增强趣味性。
难点突破:利用动态模拟软件(如COMSOL)展示浓度变化曲线,直观理解瞬时速率与导数的关系。
拓展阅读:阿伦尼乌斯方程与活化能理论(网页29、49)可作为高阶内容,供学有余力的学生探究。
通过教案设计与公式解析的结合,学生不仅能掌握化学反应速率的计算方法,还能通过实验和理论理解其微观机制,培养科学探究能力。



